Składniki pod lupą cz. 1 – koenzym
| Autor: Prof. Dr Hab. N. Med. Magdalena Górska-PonikowskaZ tego artykułu dowiesz się:
- czym jest koenzym Q10,
- jakie jego ciekawe charakterystyki są przedmiotem badań,
- gdzie możliwe jest jego praktyczne wykorzystanie.
Koenzym Q10, prezentuje wiele ciekawych właściwości oraz obiecujących sposobów wykorzystania go – zwłaszcza jako przeciwutleniacza, będącego w stanie pomóc w walce z procesami starzenia się skóry i tkanek.
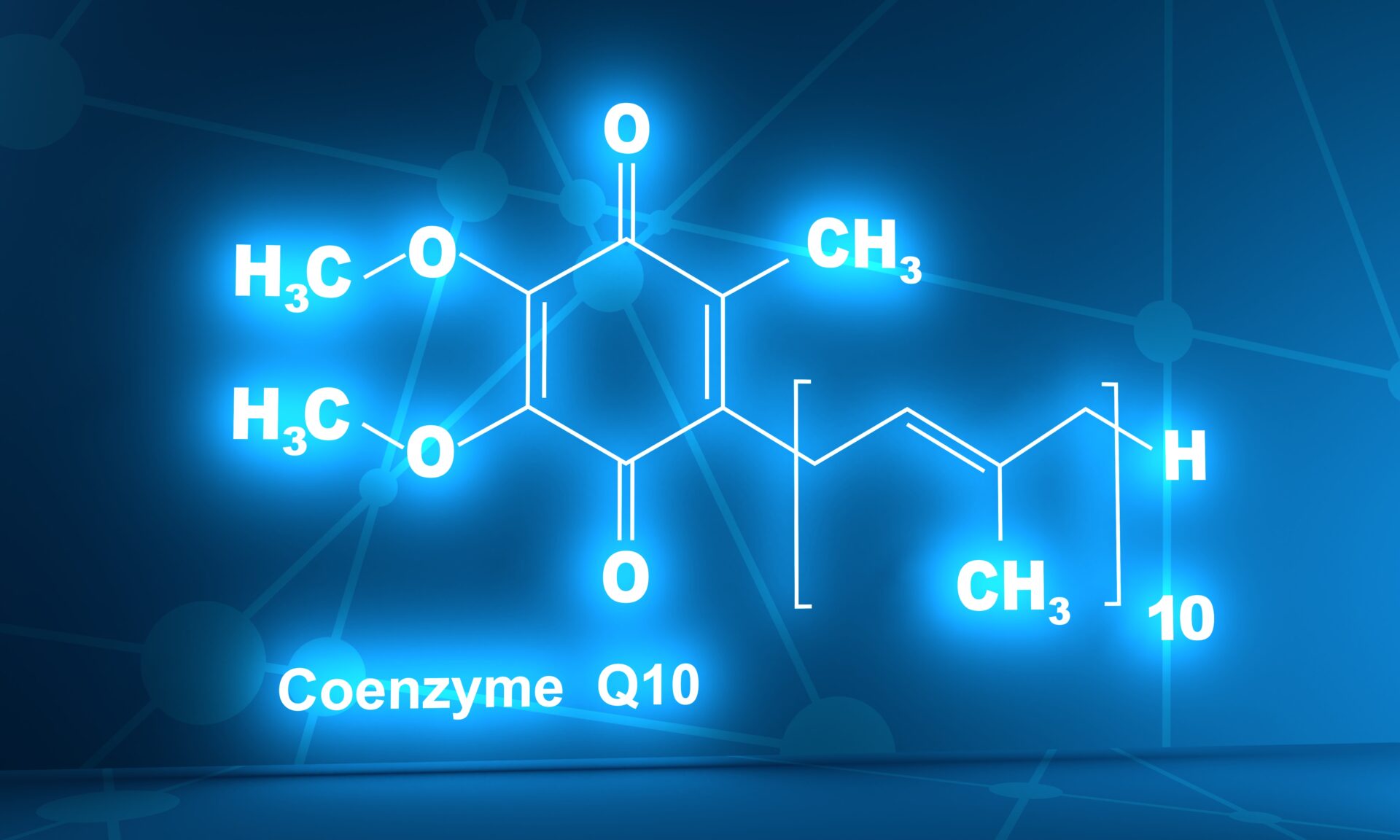
Koenzym Q10 to związek aktywny biologicznie z chemicznej grupy chinonów, zawierający hydrofobowy ogon izoprenoidowy. Nazywany jest wymiennie ubichinonem lub ubichinolem (w zależności od tego, czy mówimy o jego formie utlenionej, czy zredukowanej CoQ10H2), Q10 oraz witaminą Q10 [1].
Dwie funkcje Koenzymu Q10
Koenzym Q10 pełni dwie główne funkcje biologiczne. Po pierwsze, wspiera bioenergetykę mitochondrialną. Po drugie, w swojej zredukowanej formie – jako ubichinol CoQ10H2 – jest przeciwutleniaczem, który działa jako donor elektronów skuteczny w hamowaniu peroksydacji lipidów błon biologicznych, a także wywiera działanie antyapoptotyczne [2].
Z uwagi na swoją budowę i właściwości fizyko-chemiczne CoQ10 (zred. ubichinol) jest silnym przeciwutleniaczem w środowisku lipofilowym – zarówno poprzez bezpośrednią neutralizację reaktywnych form tlenu (z ang. Reactive oxygen species, ROS), jak i wpływ na regenerację lipofilowych i hydrofilowych przeciwutleniaczy, takich jak tokoferol i witamina C. Ponadto wykazano, że koenzym Q10 wywiera działanie przeciwapoptotyczne, przeciwdziałając uwalnianiu ceramidu ze sfingomieliny.
Stąd koenzym Q10 „wykazuje działanie antyapoptotyczne i antyoksydacyjne, wywierając również wpływ na mikrośrodowisko, co zostało potwierdzone na modelach in vitro i in vivo” [3]. Ponadto stosunek CoQ10H2/CoQ10 może być wykorzystany jako potencjalny marker stresu oksydacyjnego in vivo [4]. Zarówno antyoksydacyjna, jak i bioenergetyczna rola koenzymu Q10 jest głęboko związana z procesem starzenia, w szczególności ze stochastyczną teorią starzenia się [5‒8]. Teoria ta implikuje przypadkowe uszkodzenie komórek w wyniku mutacji zachodzących podczas procesów metabolicznych spowodowanych wytwarzaniem ROS. W rzeczywistości mitochondria są krytycznym miejscem reprezentującym zarówno źródło, jak i cel ROS. Podczas starzenia się komórek zwiększone uwalnianie ROS przez mitochondria może wywołać błędne koło, obejmujące nagromadzenie uszkodzeń oksydacyjnych błon mitochondrialnych i kompleksów oddechowych, co prowadzi do zwiększonej produkcji ROS [5‒7].
Koenzym Q10, jako skórny przeciwutleniacz, występuje w naskórku w 10-krotnie wyższych stężeniach w porównaniu ze skórą właściwą [5‒8]. Ponieważ naskórek jest bezpośrednio narażony na czynniki środowiskowe, takie jak promieniowanie UV, jest również podatny na wyczerpanie przeciwutleniaczy skórnych, takich jak koenzym Q10. Biosynteza CoQ10 zmniejsza się wraz z wiekiem, co powoduje zmniejszenie jego skuteczności antyoksydacyjnej.
Od środka i od zewnątrz
Z uwagi na jego dobroczynne właściwości, suplementacja koenzymem Q10, jak i podanie miejscowe w różnych formach kosmetycznych, stały się przedmiotem wielu badań in vivo oraz in vitro. Korzyści terapeutyczne wynikające z suplementacji koenzymem Q10 przedstawione zostały w licznych zwierzęcych modelach chorób i badaniach na ludziach, zwłaszcza w stanach związanych z wiekiem i stresem oksydacyjnym [5‒12]. Efekt działania uzależniony jest od dawki oraz formy podania/postaci leku. Wykazano również, że statyny znacząco wpływają na syntezę koenzymu Q10 [11]. Jest to związane z faktem, iż koenzym Q10 jest wytwarzany z produktu pośredniego syntezy cholesterolu.
Ponadto unaoczniono, że miejscowe podawanie produktów na bazie koenzymu Q10 zapobiega fotostarzeniu poprzez zmniejszenie poziomu utleniania i głębokości zmarszczek. Dlatego też koenzym Q10 jest z powodzeniem wykorzystywany jako aktywny składnik produktów do stosowania miejscowego, w tym kosmetyków [5‒12].
Wnikanie koenzymu Q10
Jednak w celu uzyskania skórnego działania przeciwutleniającego i regulującego prace mitochondriów, koenzym Q10 musi pokonać barierę rogową skóry i przeniknąć do żywych warstw naskórka. Koenzym Q10 wykazuje niską rozpuszczalność w wodzie (0,193 μg/ml) ze względu na swoją dużą masę cząsteczkową (863,36 g/mol) i wysoką lipofilowość przy wartości logP wynoszącej 21. Ogranicza to jego penetrację w głąb skóry i wyjaśnia tendencję do osadzania się w warstwie rogowej naskórka. Ponadto koenzym Q10 rozkłada się pod wpływem światła. Stąd penetracja koenzymu Q10 przez skórę z konwencjonalnych preparatów jest słaba i nie może dostarczyć go do docelowych warstw skóry. Prócz tego konwencjonalne preparaty nie przedłużają uwalniania koenzymu Q10 do skóry.
Jedną z najbardziej popularnych, ale również i efektywnych form poprawy biodostępności koenzymu Q10 wobec skóry, jak i innych barier biologicznych, jest jego enkapsulacja w systemach nośnych [12]. Inną formą jest optymalizacja współczynnika lipofilowości/hydrofilowości podłoża preparatu z koenzymem Q10 [12]. Badania potwierdzają również skuteczność stosowania miejscowych preparatów z koenzymem Q10 w połączeniu z powierzchownymi i/lub średniogłębokimi środkami peelingującymi do leczenia fotouszkodzonej skóry [13].
Koenzym Q10, jako skórny przeciwutleniacz, występuje w naskórku w 10-krotnie wyższych stężeniach w porównaniu ze skórą właściwą.
Referencje
CZYTAJ POZOSTAŁE CZĘŚCI SERII
Składniki pod lupą cz. 2 – kurkumina
Składniki pod lupą cz. 3 – witamina C
Składniki pod lupą cz. 4 – niacynamid
Składniki pod lupą cz. 5 – krocyna
Składniki pod lupą cz. 6 – probiotyki i lizaty bakteryjne
Składniki pod lupą cz. 7 – retinol i pochodne
Składniki pod lupą cz.8 – senolityki
Może Cię zainteresować
Treści wybrane specjalnie z myślą o Tobie






